Sử dụng Ozone an toàn
Khi tiếp xúc với khí ozone nồng độ nhất định trong thời gian đủ dài, mắt có thể bị cay, họng, mũi bị rát. Phổi có thể bị tổn thương. Ozone có thể gây đau đầu, buồn nôn, cảm giác lơ mơ, khó chịu.
Vì vậy cần tuân thủ các qui định an toàn ozone, nhất là khi tiếp xúc với khi ozone. Dưới đây là các quy định của ba cơ quan an toàn ozone của Mỹ: OSHA (Occupational Safety and Health Administration / Cơ quan quản lý an toàn và sức khỏe nghệ nghiệp, NIOSH (The National Institute for Occupational Safety and Health / Viện Quốc gia về an toàn và sức khỏe nghề nghiệp) và FDA (Food and Drug Administration / Cơ quan quản lý Thực phẩm và Thuốc). Giới hạn cho phép khi tiếp xúc với ozone như sau:
Ozone là chất oxi hóa mạnh nên ozone trong không khí có thể gây hại cho người và sinh vật nếu dùng quá liều lượng. Liều lượng Q là tích số giữa nồng độ ozone C (ppm hay g/m3) nhân với thời gian phơi nhiễm T (phút): Q = C * T (ppm * phút hay mg/lít * phút).
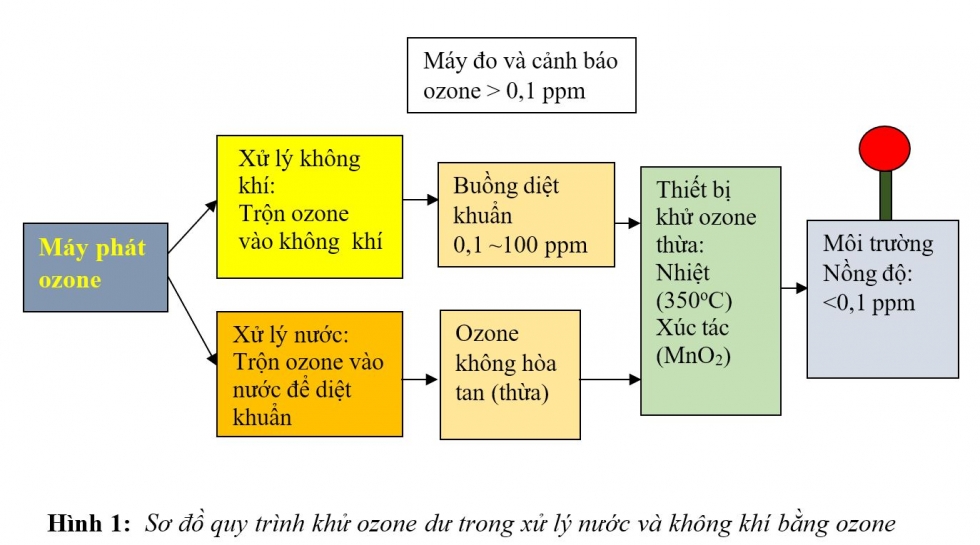
Vậy nên trong nhiều ứng dụng ta phải loại bỏ khí ozone dư trước khi xả ra môi trường. Có hai phương pháp loại bỏ ozone dư thường được áp dụng là:
1. Phương pháp nhiệt
 3O₂ + corona (Silent electric discharge) ⇄ 2 O₃ trong đó sự thay đổi enthalpy bằng ΔH (298 K) = + 142 kJ mol⁻¹ (phản ứng thu nhiệt, nhận năng lượng/endothermic)
3O₂ + corona (Silent electric discharge) ⇄ 2 O₃ trong đó sự thay đổi enthalpy bằng ΔH (298 K) = + 142 kJ mol⁻¹ (phản ứng thu nhiệt, nhận năng lượng/endothermic)
Mọi vật có năng lượng cao đều không bền vững, vì vậy ozone tự phân hủy để trở thành oxi O3 -> O2 (bền vững hơn). Phản ứng này tỏa nhiệt (exothermic) tức là không tốn năng lượng mà phát ra năng lượng (sự thay đổi năng lượng tự do hay enthalpy là âm).Trong bảng 2 có thể thấy thời gian bán phân hủy ozone trong nước (sạch) và trong không khí theo nhiệt độ. Nhiệt độ càng cao, thời gian phân hủy càng ngắn. Tại nhiệt độ 20 độ C, thời gian bán phân hủy của ozone trong không khí là 3 ngày còn trong nước là 20 phút. Sở dĩ thời gian phân hủy trong nước ngắn hơn nhiều so với trong không khí vì trong không khí, ozone tự phân hủy để giảm năng lượng còn trong nước ozone bị tiêu hao do tương tác với nước tạo ra H2O2, các gốc tự do OH*, O và O2.
Bảng 2: Thời gian bán phân hủy của ozone trong không khí và trong nước
Trong không khí, tại nhiệt độ 300 oC, phân tử ozone tồn tại trong 3s, tại nhiệt độ 350 oC, O3 tồn tại trong vài ms. Như vậy các đơn giản nhất để loại bỏ ozone dư sau khi sử dụng là nung ozone trong môi trường nhiệt độ trên 300 oC. Quá trình này cần lưu ý tới lưu lượng và tốc độ khí chứa ozone cần xử lý.
Hình 2 là sơ đồ đo nồng độ ozone suy giảm trong quá trình xử lý nhiệt từ nhiệt độ phòng lên tới 250 oC mà tôi đã thực hiện tại Công ty BKIDT:
Hình 3: Sự suy giảm nồng độ ozone theo nhiệt độ.
Vì vậy cần tuân thủ các qui định an toàn ozone, nhất là khi tiếp xúc với khi ozone. Dưới đây là các quy định của ba cơ quan an toàn ozone của Mỹ: OSHA (Occupational Safety and Health Administration / Cơ quan quản lý an toàn và sức khỏe nghệ nghiệp, NIOSH (The National Institute for Occupational Safety and Health / Viện Quốc gia về an toàn và sức khỏe nghề nghiệp) và FDA (Food and Drug Administration / Cơ quan quản lý Thực phẩm và Thuốc). Giới hạn cho phép khi tiếp xúc với ozone như sau:
- OSHA, NIOSH: mức phơi (tiếp xúc) ozone cho phép: 0.1 ppm (0.2 mg/mét khối), 8 giờ/ngày, 40 giờ/ tuần.
- OSHA, NIOSH: mức phơi (tiếp xúc) ozone cho phép trong thời gian ngắn: 0.3 ppm (0,6 mg/mét khối) trong 15 phút.
- OSHA, NIOSH: mức nguy hiểm tức thời cho sức khỏe và tính mạng: 5 ppm (10 mg/mét khối).
- FDA: phơi (tiếp xúc) liên tục với ozone: cho phép 0.05 ppm (0.1 mg/mét khối).
Ozone là chất oxi hóa mạnh nên ozone trong không khí có thể gây hại cho người và sinh vật nếu dùng quá liều lượng. Liều lượng Q là tích số giữa nồng độ ozone C (ppm hay g/m3) nhân với thời gian phơi nhiễm T (phút): Q = C * T (ppm * phút hay mg/lít * phút).
- Liều lượng an toàn được chấp nhận là dưới 0,1 ppm trong 8 giờ làm việc tức là người ta có thể làm việc 8 giờ trong không khí chứa ozone nồng độ 0,1 ppm. Bảng 1 cho thấy ảnh hưởng của ozone lên các sinh vật và con người, nồng độ ozone trong không khí dưới 0,1 ppm được coi là ngưỡng an toàn đối với người.
- Ở Mỹ, tại các thành phố lớn, mật độ ô tô cao. Khí xả từ xe hơi dưới tác động của tia UV trong nắng tạo ra khí ozone khói, ozone đồng hành, đôi khi vượt ngưỡng an toàn (0,5 -1,0 ppm), khi đó người ta phát cảnh báo số 1- số 3 (Bảng 1).
- Trong bảng 1 có thể thấy ảnh hưởng của khí ozone đến con người và sinh vật, và chỉ ra các ngưỡng an toàn.
| Nồng độ ozone trong không khí, (ppm) | Tác động đến động, thực vật | Ghi chú |
| 0.001 | Ít người cảm nhận được mùi ozone | |
| 0.003 -0.01 | Người thường ngửi thấy mùi ozone | |
| 0.02 | Đo được tương đối chính xác tại Phòng thí nghiệm | |
| 0.02-0.04 | Nồng độ trung bình tại các thành phố (1964) | |
| 0.05 | Ngưỡng cho phép đối với các thiết bị điện - điện tử | Thí dụ máy photocopy |
| 0.1 | Ngưỡng cho phép tại các xí nghiệp, (8 giờ/ngày, 6 ngày/tuần) | |
| 0.15-0.5 | Ngưỡng đỉnh tại các thành phố ở Mỹ | |
| 0.2 | Thí nghiệm ở người, chưa gây khó chịu | |
| 0.3 |
Mũi họng khó chịu
Một số cỏ cây có biểu hiện khác thường
|
|
| 0.5 |
Tại Los Angeles, California: báo động cấp 1
Một số người: buồn nôn, phù, khó thở
|
|
| 1-2 |
Báo động 2, Báo động 3 (1.5 ppm)
Trong hai giờ, người tình nguyện có triệu chứng ốm, đau đầu, đau ngực
|
|
| 1.4-5.6 | 70 phút: cây lá bị tổn thương mạnh, rụng | |
| 5-25 | 3 giờ, 12 ppm: lợn châu Phi chết. 4 ppm: gây bỏng mắt, phổi, 9 ppm: phù nặng và di chứng lâu | |
| >25 | 50 ppm, 60 phút: gây chết ở động vật (người có thể chết) | Chưa thử ở người |
Vậy nên trong nhiều ứng dụng ta phải loại bỏ khí ozone dư trước khi xả ra môi trường. Có hai phương pháp loại bỏ ozone dư thường được áp dụng là:
1. Phương pháp nhiệt
Phân tử ozone không bền và tự phát phân hủy thành oxi. Có thể giải thích tính không bền của ozone bằng luật bảo toàn năng lượng: để tạo ra ozone, cần môi trường phóng điện corona, trong môi trường này các điện tử có năng lượng cao truyền năng lượng cho oxi để tạo thành ozone:
Mọi vật có năng lượng cao đều không bền vững, vì vậy ozone tự phân hủy để trở thành oxi O3 -> O2 (bền vững hơn). Phản ứng này tỏa nhiệt (exothermic) tức là không tốn năng lượng mà phát ra năng lượng (sự thay đổi năng lượng tự do hay enthalpy là âm).Trong bảng 2 có thể thấy thời gian bán phân hủy ozone trong nước (sạch) và trong không khí theo nhiệt độ. Nhiệt độ càng cao, thời gian phân hủy càng ngắn. Tại nhiệt độ 20 độ C, thời gian bán phân hủy của ozone trong không khí là 3 ngày còn trong nước là 20 phút. Sở dĩ thời gian phân hủy trong nước ngắn hơn nhiều so với trong không khí vì trong không khí, ozone tự phân hủy để giảm năng lượng còn trong nước ozone bị tiêu hao do tương tác với nước tạo ra H2O2, các gốc tự do OH*, O và O2.
Bảng 2: Thời gian bán phân hủy của ozone trong không khí và trong nước
| Trong Khí | Trong Nước | ||
| Độ C | Thời gian bán phân hủy | Độ C | Thời gian bán phân hủy |
| -50 | 3 tháng | 15 | 30 phút |
| -35 | 18 ngày | 20 | 20 phút |
| -25 | 8 ngày | 25 | 15 phút |
| 20 | 3 ngày | 30 | 12 phút |
| 120 | 90 phút | 35 | 8 phút |
| 250 | Vài giây | - | - |
Trong không khí, tại nhiệt độ 300 oC, phân tử ozone tồn tại trong 3s, tại nhiệt độ 350 oC, O3 tồn tại trong vài ms. Như vậy các đơn giản nhất để loại bỏ ozone dư sau khi sử dụng là nung ozone trong môi trường nhiệt độ trên 300 oC. Quá trình này cần lưu ý tới lưu lượng và tốc độ khí chứa ozone cần xử lý.
Hình 2 là sơ đồ đo nồng độ ozone suy giảm trong quá trình xử lý nhiệt từ nhiệt độ phòng lên tới 250 oC mà tôi đã thực hiện tại Công ty BKIDT:
- Một máy phát ozone cấp ozone vào lò nung với lưu lượng cố định.
- Nhiệt độ lò nung được khống chế và giữ trong 3 phút cho ổn định, sau đó bơm ozone vào lò trong 2 phút.
- Nồng độ ozone ra khỏi lò được đo bằng máy đo theo nguyên lý hấp thụ tia UV.
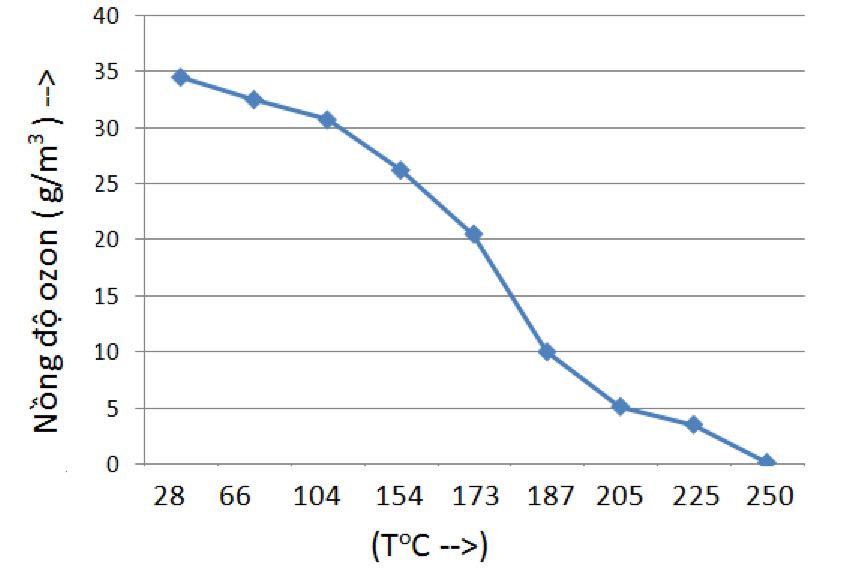
- Kết quả đo sự phụ thuộc nồng độ ozone vào nhiệt độ trình bày trên Hình 3. Nồng độ ozone giảm dần theo nhiệt độ và có thể thấy tại nhiệt độ 250 độ C, nồng độ ozone ghi nhận được sấp sỉ bằng 0 g/m3.
- Kết quả này cho phép thiết kế các thiết bị khử ozone thừa (ozone destroyer) bằng phương pháp nhiệt trong các qui trình xử lý nước và không khí.
Khí ozone với nồng độ ban đầu tại nhiệt độ phòng là ~34 g ozone/m3 được đưa vào buồng nhiệt sau đó đi vào máy đo nồng độ. Lưu lượng ozone ~ 1 L/phút. Nhiệt độ buồng được đặt, đo và giữ cho ổn định trong 3 phút. Theo chiều tăng nhiệt độ, nồng độ ozone giảm dần và xuống sấp sỉ bằng 0 g/m3 tại nhiệt độ 250 độ C.
Hình 3: Sự suy giảm nồng độ ozone theo nhiệt độ.
2. Phương pháp xúc tác:
Ozone O3 có thế năng cao hơn oxi O2, vì vậy quá trình phân hủy ozone là quá trình tự phát (tỏa nhiệt). Trong không khí và ở nhiệt độ phòng, ozone cần vài ngày để phân hủy. Vì vậy để tăng tốc độ phân hủy có thể dùng các chất xúc tác cho quá trình đó. Xúc tác có thể là quá trình hóa học hoặc vật lý. Thí dụ, chất nổ TNT chỉ nổ khi có kích thích nhiệt (nhiệt là tác nhân kích thích quá trình nổ). Xúc tác bằng hóa chất rất thường gặp. Thí dụ, H2O2 + KMnO4 -->H2O + O2. Sản phẩm của phản ứng này không chứa K, Mn tức là KMnO4 không tham gia phản ứng, không bị tiêu hao trong quá trình phản ứng. KMnO4 đóng vai trò chất xúc tác làm cho phản ứng nhanh hơn hay xảy ra tại nhiệt độ thấp hơn.
Dioxit mangan là chất xúc tác cho quá trình phân hủy ozone, làm cho quá trình này xảy ra nhanh hơn: O3 + MnO2 -> O2.
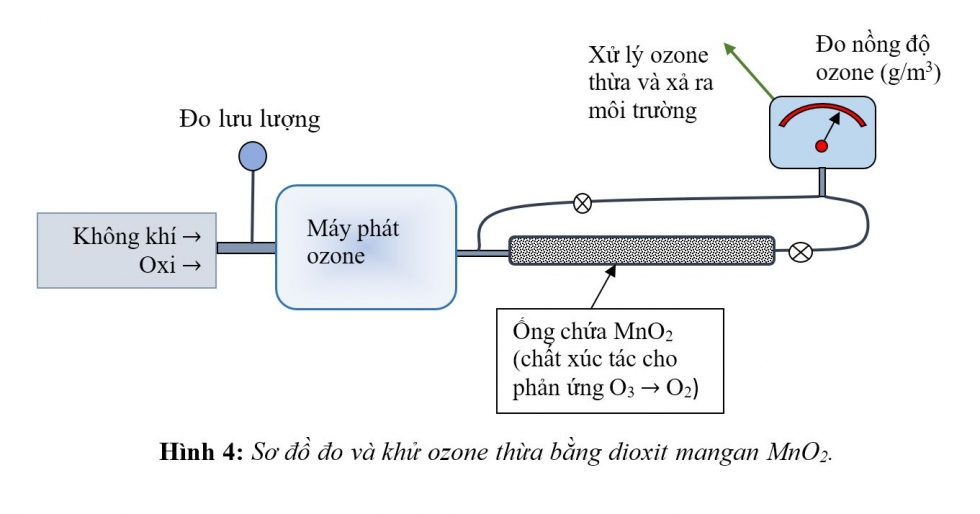
Sơ đồ đo sự phân hủy ozone bằng xúc tác MnO2 trình bầy trên hình 4. Ozone với nồng độ 27 g/m3 từ máy phát đi vào một ống chứa MnO2 dạng bột. Khối lượng MnO2 là 1 kg cho vào ống xúc tác hình trụ, đường kính = 80 mm, dài = 300 mm. Lưu lượng khí là 1 lít/phút. Khí ozone đi qua ống xúc tác vào máy đo nồng độ. Kết quả là, nồng độ ozone giảm khoảng 90 lần khí đi qua ống xúc tác, từ 27 g/m3 xuống 0,3 g/m3. Thời gian tương tác ước tính trên 1 phút (trong điều kiện thông thường, cần vài ngày để phân hủy ozone).
Ozone O3 có thế năng cao hơn oxi O2, vì vậy quá trình phân hủy ozone là quá trình tự phát (tỏa nhiệt). Trong không khí và ở nhiệt độ phòng, ozone cần vài ngày để phân hủy. Vì vậy để tăng tốc độ phân hủy có thể dùng các chất xúc tác cho quá trình đó. Xúc tác có thể là quá trình hóa học hoặc vật lý. Thí dụ, chất nổ TNT chỉ nổ khi có kích thích nhiệt (nhiệt là tác nhân kích thích quá trình nổ). Xúc tác bằng hóa chất rất thường gặp. Thí dụ, H2O2 + KMnO4 -->H2O + O2. Sản phẩm của phản ứng này không chứa K, Mn tức là KMnO4 không tham gia phản ứng, không bị tiêu hao trong quá trình phản ứng. KMnO4 đóng vai trò chất xúc tác làm cho phản ứng nhanh hơn hay xảy ra tại nhiệt độ thấp hơn.
Dioxit mangan là chất xúc tác cho quá trình phân hủy ozone, làm cho quá trình này xảy ra nhanh hơn: O3 + MnO2 -> O2.
Sơ đồ đo sự phân hủy ozone bằng xúc tác MnO2 trình bầy trên hình 4. Ozone với nồng độ 27 g/m3 từ máy phát đi vào một ống chứa MnO2 dạng bột. Khối lượng MnO2 là 1 kg cho vào ống xúc tác hình trụ, đường kính = 80 mm, dài = 300 mm. Lưu lượng khí là 1 lít/phút. Khí ozone đi qua ống xúc tác vào máy đo nồng độ. Kết quả là, nồng độ ozone giảm khoảng 90 lần khí đi qua ống xúc tác, từ 27 g/m3 xuống 0,3 g/m3. Thời gian tương tác ước tính trên 1 phút (trong điều kiện thông thường, cần vài ngày để phân hủy ozone).